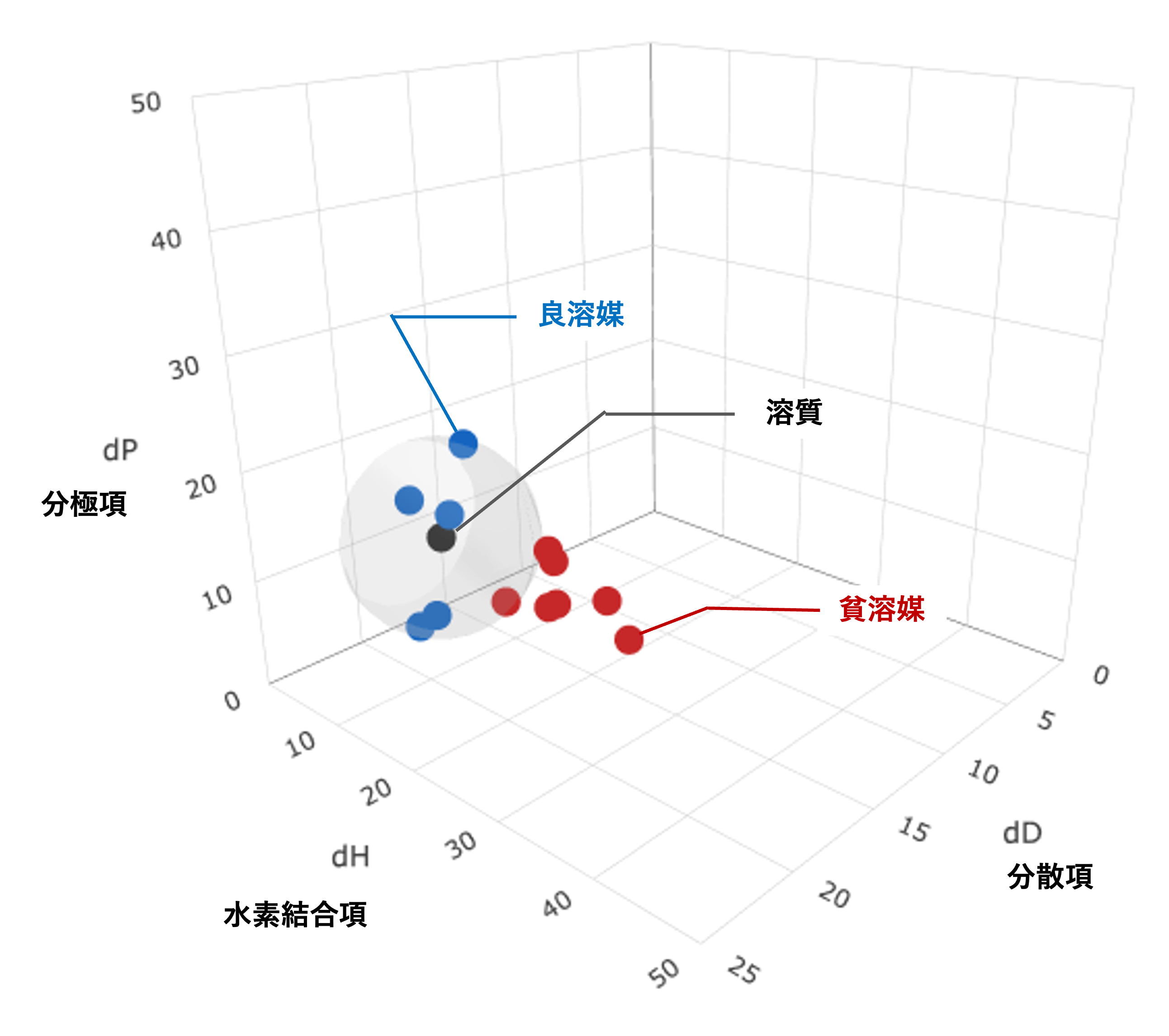
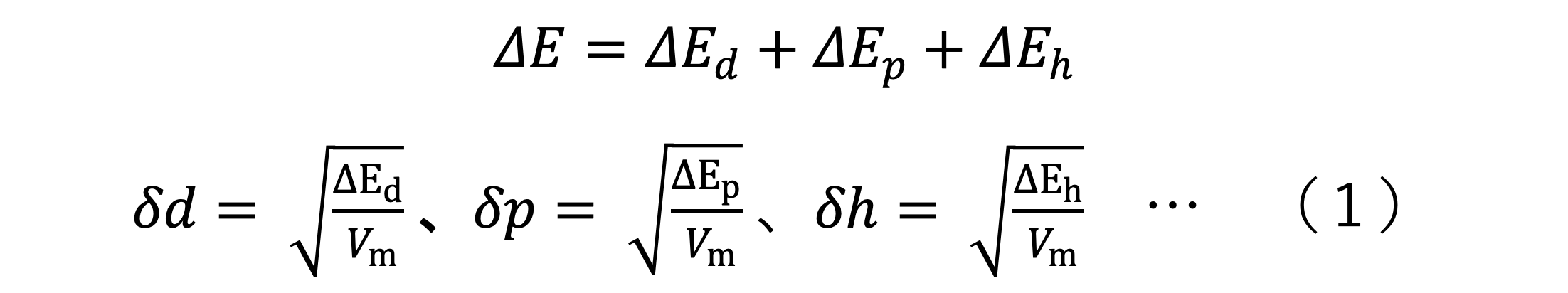Hildebrand溶解度パラメータδは、「物質の凝集エネルギー密度」をもとにした一次元の物理量で、無極性溶媒や低極性分子において、溶解性を推測に利用することができます。一方、極性分子や水素結合を持つ物質の溶解性を推測するためには、双極子相互作用や水素結合を考慮する必要があるため、推測精度には限界がありました。
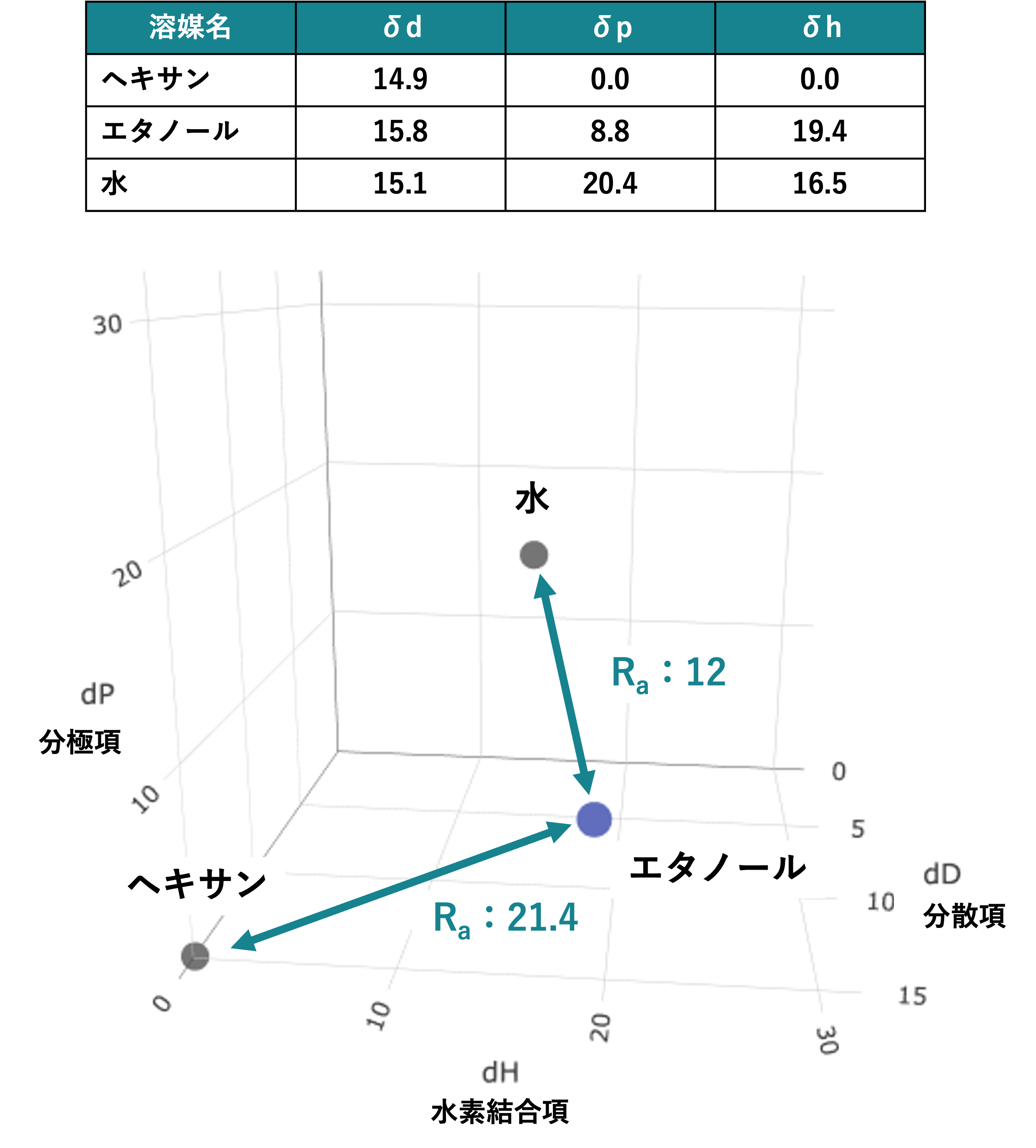
たとえば、極性溶媒のエタノール(δ = 12.7)と、無極性溶媒のヘキサン(δ = 7.3)は、Hildebrand溶解度パラメータが近いにも関わらず混和しない一方、エタノールと溶解度パラメータの値が離れている水(δ = 23.4)には混和します。このような現象をHildebrand溶解度パラメータでは説明できませんでした。