ギブズ自由エネルギー(Gibbs Free Energy)とは、任意の化学反応や物理的変化が「自然に進行するかどうか」を判断するための熱力学における重要な概念です。ギブズ自由エネルギーは次の式で定義されます。

ギブズ自由エネルギー変化ΔG < 0 の場合、その変化は自発的に進みます。つまり、物質が溶媒に溶けるためには、ギブズ自由エネルギー変化ΔGが負(マイナス)である必要があります。
ギブズ自由エネルギー(Gibbs Free Energy)とは、任意の化学反応や物理的変化が「自然に進行するかどうか」を判断するための熱力学における重要な概念です。ギブズ自由エネルギーは次の式で定義されます。

ギブズ自由エネルギー変化ΔG < 0 の場合、その変化は自発的に進みます。つまり、物質が溶媒に溶けるためには、ギブズ自由エネルギー変化ΔGが負(マイナス)である必要があります。

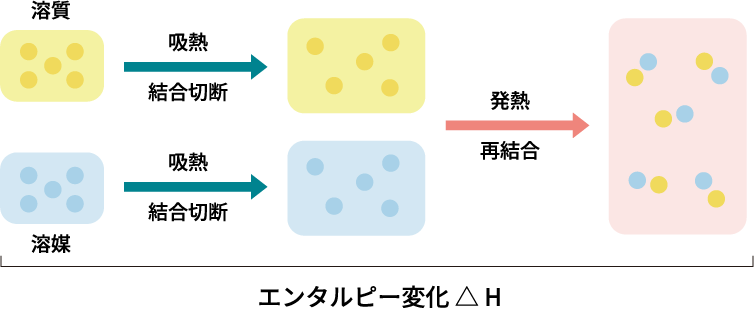
物質(溶質)が溶媒に溶ける現象は、いくつかのエネルギー的な変化を考える必要があります。具体的には、
1. 溶質の分子間の結合を切断する(吸熱過程)
2. 溶媒の分子間の結合を切断する(吸熱過程)
3. 溶質と溶媒が結びつく(発熱過程)
これらのエネルギー変化の総和がエンタルピー変化ΔH に該当しています。また、分子が混ざり合うことで系全体の無秩序さが増すため、エントロピー変化ΔSは正の値になることが一般的です。たとえば、砂糖が水に溶けるときは、砂糖分子間との結合が切断され(吸熱反応)、水分子が砂糖分子と結びつく(発熱反応)ことで、最終的に溶解が進むことになります。
Hildebrand溶解度パラメータやHansen溶解度パラメータは、物質の凝集エネルギーや分子間相互作用をもとにした、2つの異なる物質が結びつく際の「エネルギー的な親和性」を表現するための指標となります。
つまり、溶解度パラメータの差が小さい場合は、ギブズ自由エネルギーの「エンタルピー変化ΔH」が小さい(エネルギー障壁が低い)ことを意味しています。これにより、ギブズ自由エネルギー変化ΔGが負になる可能性が高くなるため、溶解性を推測することができます。
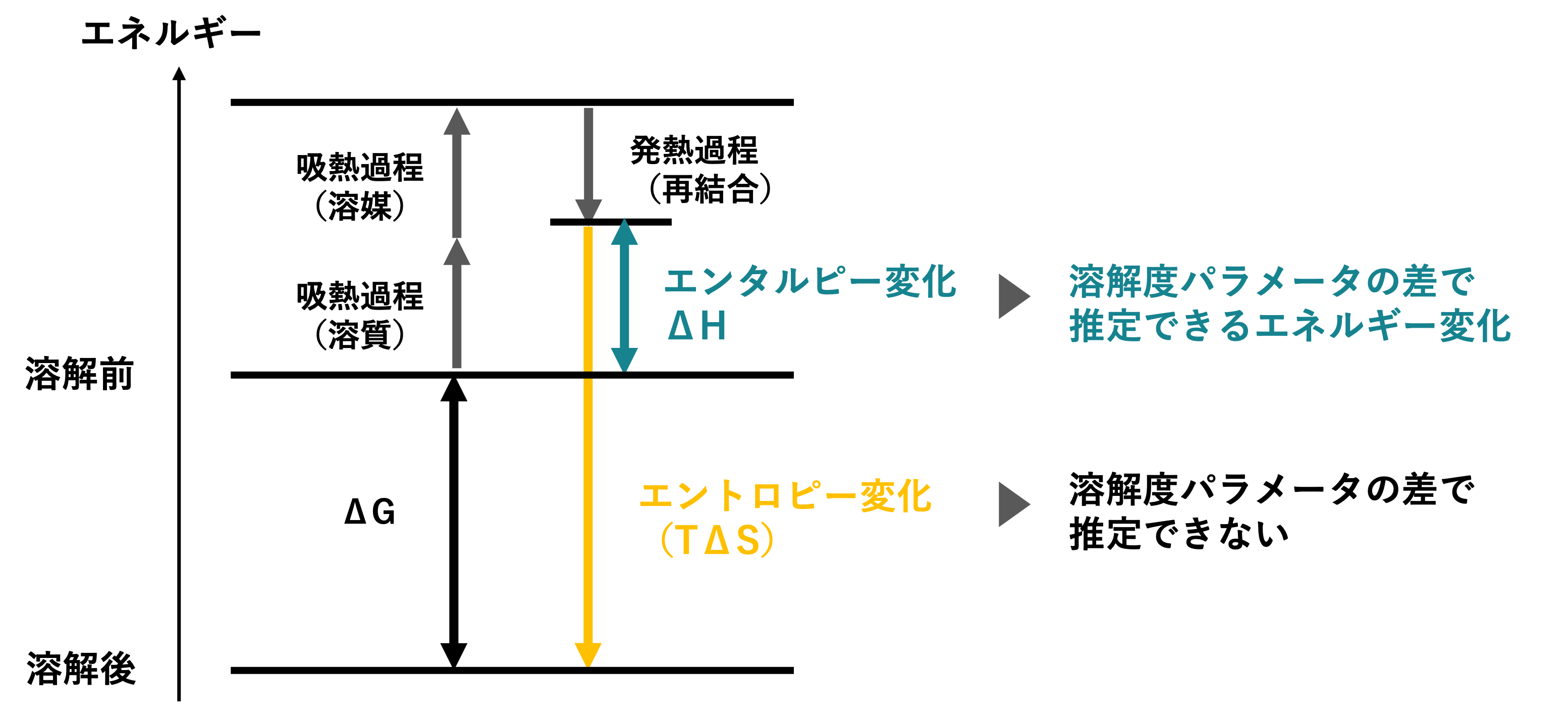
溶解度パラメータは「エンタルピー変化ΔH」を推測する一方、「エントロピー変化ΔS」は、分子の柔軟性、空間配置、運動自由度という「分子レベルでのランダムさ」を表すため、溶解度パラメータでは推測できません。
溶解現象では、温度上昇すると溶解性が向上すると知られていますが、ギブズ自由エネルギーの式から、エントロピー項(-TΔS)への影響が大きいため、溶解度パラメータでの推測は困難となります。
また、溶解度パラメータの差が小さく、エンタルピー変化ΔHが小さい場合でも、エントロピー変化ΔSが小さい場合(例えば、結晶性高分子)は「溶解」せず、「膨潤」という現象として観測されます。
溶解現象は「エネルギー」の視点から見ると、ギブズ自由エネルギー変化ΔGが負になるときに自発的に進むことがわかります。溶解度パラメータは、特にエンタルピー変化ΔHの大きさを推測するために便利な指標になります。
他方、溶解度パラメータではエントロピー変化ΔSの推測は困難なため、物質の特性によって溶解現象でなく、膨潤現象として観測されることもあります。

SoluVisionの導入効果、ユーザーの声をまとめた総合カタログを公開。 業界別の活用シーンや導入ワークフロー、溶解度パラメータ(sp)一覧も掲載。 研究開発における「組み合わせ」を、“勘”から“定量的な評価軸“へと変える。——その第一歩をぜひご覧ください。